乳腺癌作为女性最常见的癌症,是一种多因素导致的疾病,约70%的乳腺癌呈雌激素受体α阳性(ERα+)。靶向ERα信号通路的内分泌疗法是ERα+乳腺癌临床治疗的重要方式,但易产生耐药问题,导致针对单一靶点的抗乳腺癌药物无法满足临床需求。临床联合用药在一定程度上提高了癌症治疗效果并降低了耐药性,但药物之间的相互作用可能会带来一些不可预知的毒副作用。相比之下,多靶点药物被认为是一种更理想的乳腺癌治疗策略,较联合用药具有一定优势,例如可以避免由药物相互作用引起的不良反应和不易产生耐药等。
近年来,靶向蛋白降解(Targeted Protein Degradation, TPD)技术作为一种新的药物发现策略,已广泛应用于多种致病蛋白质的靶向降解,为克服耐药性提供了新思路。此外,微管蛋白在多种细胞功能中发挥重要作用,是乳腺癌治疗的重要靶点之一。研究表明,含硒化合物例如亚硒酸盐能够抑制微管蛋白聚合从而产生良好的抗肿瘤活性。该研究基于结构—导向药物设计策略,将含有硒氰药效团的功能侧链引入前期发现的OBHS和OBHSA优势药效骨架中,设计合成了一类兼具微管蛋白聚合抑制作用的新型双靶点ERα降解剂,并证实了该系列化合物具有克服ERα+乳腺癌耐药的潜力(图1)。
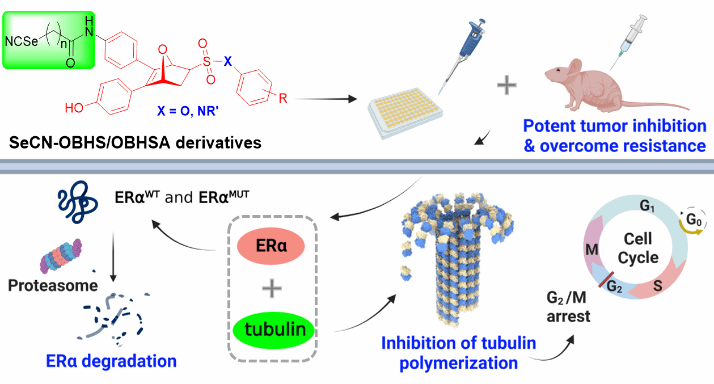
图1. 新型ERα-微管蛋白双靶点降解剂作用机制示意图
在该研究中,化合物35s和35t对不同种类的ERα+乳腺癌细胞(包括他莫昔芬敏感型和耐药型以及ERα突变型)均表现出显著的抗增殖和ERα降解活性。同时,化合物35s和35t能够抑制细胞外微管蛋白聚合,破坏他莫昔芬敏感型(MCF-7)和耐药型(LCC2)乳腺癌细胞的微管结构,并诱导细胞周期阻滞于G2/M期。在进一步的体内药效学研究中,化合物35s和35t对MCF-7和LCC2异种移植瘤裸鼠模型均表现出优异的肿瘤生长抑制作用和低组织毒性,并能有效降低ERα蛋白水平,其抑瘤效果优于临床药物氟维司群(图2)。该研究证明了这类化合物对ERα+乳腺癌细胞尤其是内分泌耐药型乳腺癌细胞具有优异的体内外抑制活性,为开发能克服内分泌耐药的抗乳腺癌药物提供了新的思路。
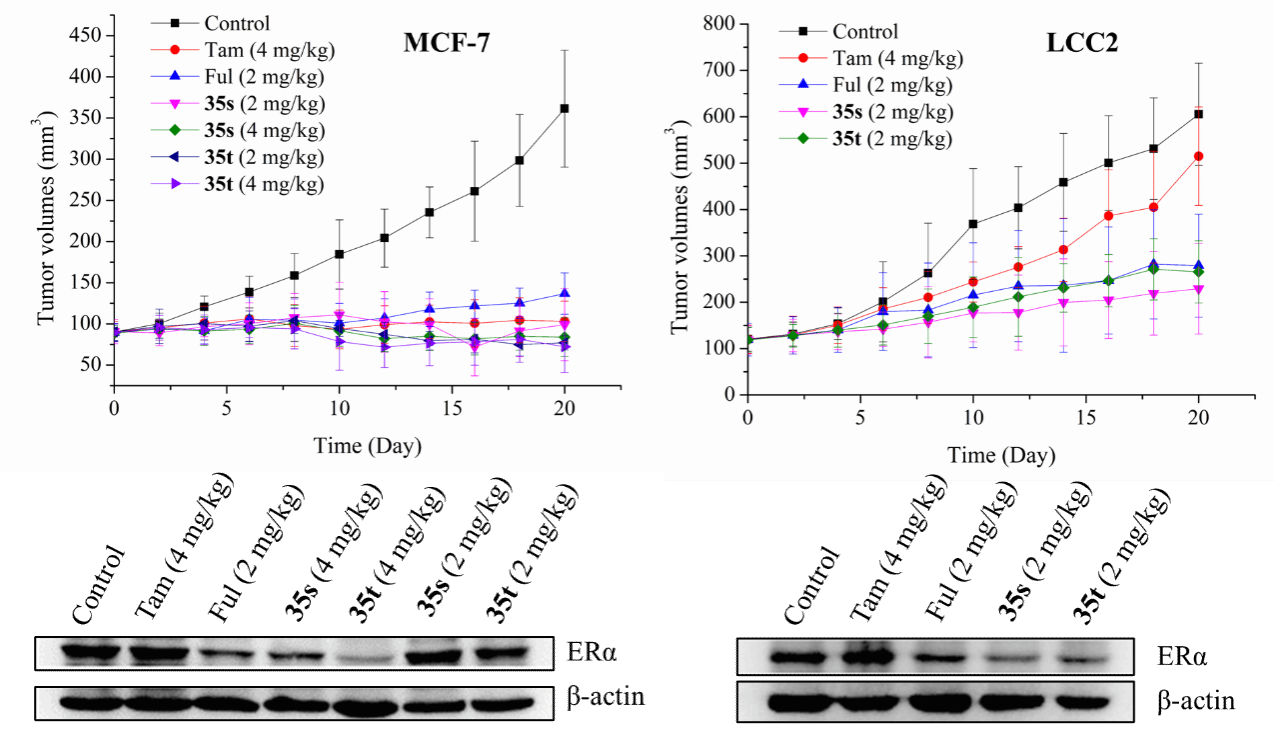
图2. 化合物35s和35t在MCF-7和LCC2异种移植小鼠模型中的抗乳腺癌活性
这一成果近期发表在药物化学顶尖期刊Journal of Medicinal Chemistry上。9778818威尼斯博士研究生邓湘萍、邓小飞、宁文涛以及辛丽兰为该论文共同第一作者;9778818威尼斯周海兵教授、生命科学学院黄健教授以及9778818威尼斯董春娥教授为该论文共同通讯作者。9778818威尼斯基础医学院梁凯威教授和9778818威尼斯闵昶教授为本课题提供了指导和技术支持。
以上研究工作得到国家重点研发计划项目、国家自然科学基金面上项目和教育部免疫与代谢前沿科学中心的支持。
文章链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.3c00465