乳腺癌是全球女性最常见的癌症,其中70%乳腺癌患者为雌激素受体α阳性(ERα+)。ERα+乳腺癌的临床治疗主要采用内分泌疗法,即通过降低雌激素水平或阻断雌激素受体(ER)信号通路来发挥抗乳腺癌作用。然而,长期使用内分泌疗法易导致原发性或继发性耐药问题,这成为ERα+乳腺癌治疗的一大挑战。因此,寻找结构和功能多样、高效低毒的新型抗耐药乳腺癌药物,是解决临床耐药并提高ERα+乳腺癌治疗效果的主要策略之一。
在该研究中,作者利用蛋白水解靶向嵌合体(PROTAC)技术及多靶点药物设计策略,通过将前期合成的同时靶向ERα和芳构化酶(ARO)的双靶点小分子化合物与多种E3配体连接,并结合该类OBHSA三维立体优势骨架优异的可调控和可修饰性,设计、合成了一系列能同时靶向降解ERα和ARO的双靶点PROTAC化合物。
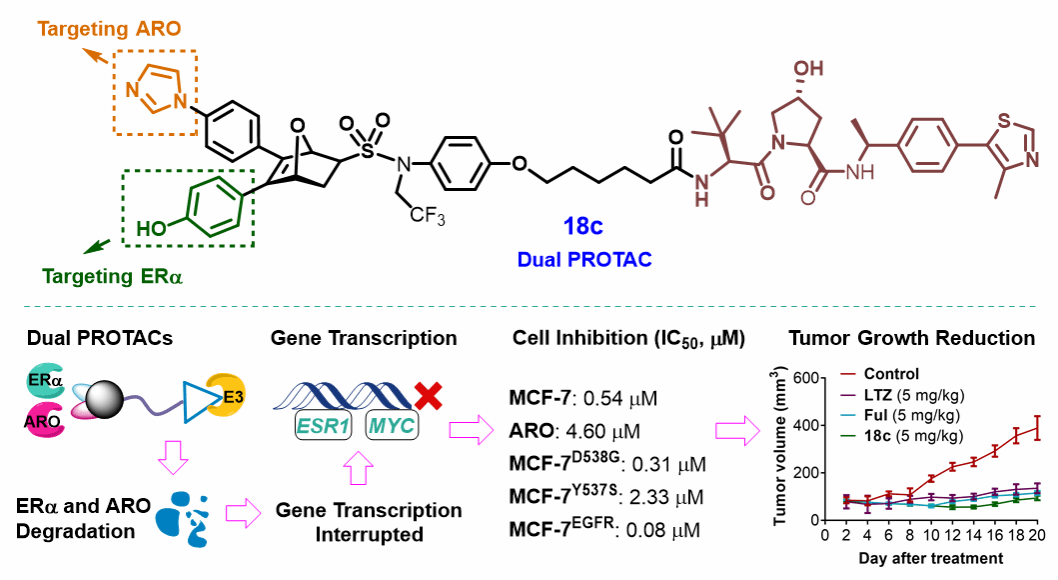
生物活性和构效关系研究表明,化合物18c在ERα+乳腺癌细胞MCF-7细胞及ERαMUT乳腺癌细胞(如MCF-7EGFR、MCF-7D538G和MCF-7Y537S)中均展现出显著的抗增殖活性,并可以有效诱导ERα和ARO降解,且抗增殖活性及降解活性优于同等剂量的临床药物氟维司群(Ful)。
同时,化合物18c能有效阻滞细胞周期、诱导细胞凋亡,并下调ESR1和MYC的mRNA水平。进一步的生物机制研究表明,化合物18c通过泛素-蛋白酶体途径诱导ERα和ARO的降解。此外,在MCF-7肿瘤模型中,化合物18c的抑瘤效果明显优于阳性对照药物来曲唑(LTZ,一种芳构化酶抑制剂)和Ful。
这一成果近期发表在药物化学顶尖期刊Journal of Medicinal Chemistry上。9778818威尼斯研究生辛丽兰、王超和程艳为该论文共同第一作者。9778818威尼斯周海兵教授及董春娥教授为该论文共同通讯作者。
以上研究工作得到国家重点研发计划项目、国家自然科学基金面上项目和教育部免疫与代谢前沿科学中心的支持。
文章链接:https://doi.org/10.1021/acs.jmedchem.4c00196