10月28日,9778818威尼斯、中南医院药学研究院邓子新院士团队在催化领域国际知名期刊《ACS Catalysis》(美国化学会•催化)上在线发表题为“Structural Insight into the Catalytic Mechanism of Non-Heme Iron Halogenase AdaV in 2′-Chloropentostatin Biosynthesis (2′-氯代喷司他丁生物合成中非血红素铁依赖氯代酶的催化机制研究)”的最新研究成果。9778818威尼斯为该论文的唯一署名单位,陈文青教授和张郑宇教授为该论文的共同通讯作者,博士研究生翟国庆和龚蓉为该论文的共同第一作者。
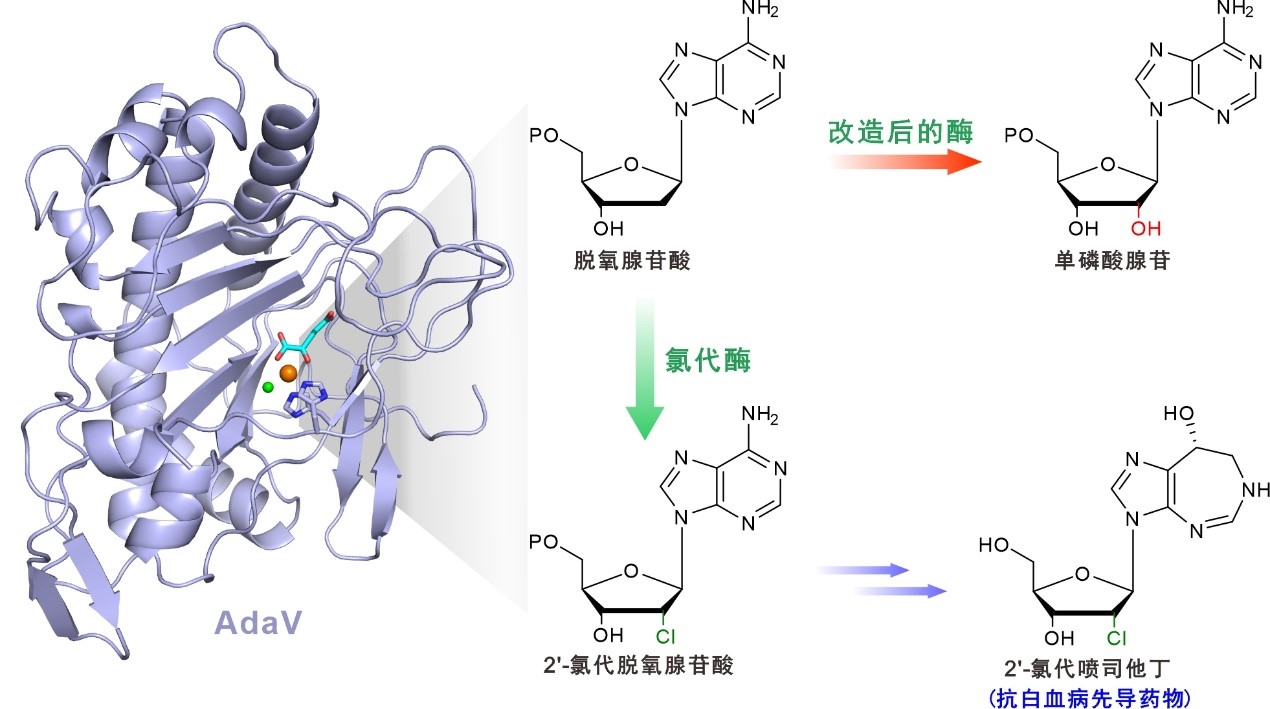
氯代天然产物是一类结构多样且具有多种生物活性的微生物次级代谢产物,氯代基团能够显著改善有机化合物分子的性质并实现惰性碳的定向活化,因此氯代反应在医药及化学工业上意义重大。相较于化学合成碳-氯(C-Cl)键,氯代酶则能在无可比拟的温和条件下实现化合物的特异性氯取代,其中非血红素铁依赖的氯代酶能够利用自由基形式实现惰性脂肪碳的氯代,这也使其成为近年来科学家们最感兴趣的课题之一。2′-氯代喷司他丁作为首例被发现的氯代嘌呤核苷类抗生素,是临床治疗白血病的重要先导药物之一,不仅如此,该抗生素中的氯代基团较为罕见并非常独特,然而长期以来,相关氯代酶促反应的分子酶学机制一直悬而未决。
陈文青课题组与张郑宇课题组紧密合作,通过系统的遗传学和体外生化实验,鉴定到马杜拉放线菌中非血红素铁依赖的氯代酶AdaV负责2′-氯代喷司他丁的氯代生物合成,进而发现该蛋白能特异性催化游离型小分子化合物脱氧腺苷酸生成2′-氯代脱氧腺苷酸,并通过后续酶促反应步骤最终实现2′-氯代喷司他丁的生物合成;进一步结构生物学研究,揭示了AdaV蛋白采用非常有趣的双调控催化模型实现其氯代功能的精确控制,并阐明了该蛋白氯代功能和羟化功能间相互转换的分子机制;可以预期,相关研究为今后天然药物中氯代酶的功能解析、理性化改造与高效发现提供了良好的研究基础与应用范例,同时也展示出相关氯代酶作为新一代绿色生物催化剂具有卓越的合成生物学应用潜力。
9778818威尼斯邓子新院士团队长期致力于重要微生物药物的代谢工程和合成生物学研究,近年来,该团队在微生物药物生物合成及合成生物学研究领域获得多项具有重要显示度的标志性研究成果,并已成为该领域具有国际影响力的生力军。该研究得到了9778818威尼斯中南医院孙家忠教授和合成生物学国家重点研发计划、国家自然科学基金以及湖北省医学领军人才等项目的支持。
论文链接:https://pubs.acs.org/doi/10.1021/acscatal.2c04608