近日,《美国科学院院刊(Proceedings of the National Academy of Sciences of the United States of America)》正式发表了9778818威尼斯邓子新院士团队孙宇辉教授课题组关于庆大霉素甲基化代谢网络催化机制的合作研究论文[1],这也是该课题组继2014和2015年连续在《Cell》子刊《Chemistry & Biology》发表庆大霉素生物合成机制系列研究成果以来[2, 3],再次在该领域取得的最新突破。在这项最新的研究成果中,孙宇辉教授课题组与剑桥大学生物化学系Peter F. Leadlay教授课题组合作,从单基因功能的探究到多基因网络的解析,全面揭示了一个全新的庆大霉素甲基化立体交叉代谢网络,为庆大霉素复杂多组分的产生提供了合理的解释,更重要的是为理性获得高效低毒庆大霉素单组分提供了一张清晰的代谢线路图。
庆大霉素(Gentamicin)作为氨基糖苷类抗生素的核心成员,由于其显著的临床疗效,一度成为治疗由革兰氏阴性菌所引发严重感染的首选药物,为人类的健康立下了汗马功劳。然而,伴随着日益严重的抗生素耐药性问题,及其内在的肾毒性和耳毒性等副作用,如何研制出更为高效安全的庆大霉素,使这一经典老药焕发出新的活力,已成为人们的迫切需求。为此,从本质上对其长久以来未曾全面解析的生物合成机制的阐明,是利用合成生物学等手段进行定向优化改造,以创新氨基糖苷类抗生素的重要基础与前提,也是当前该领域的研究热点之一。
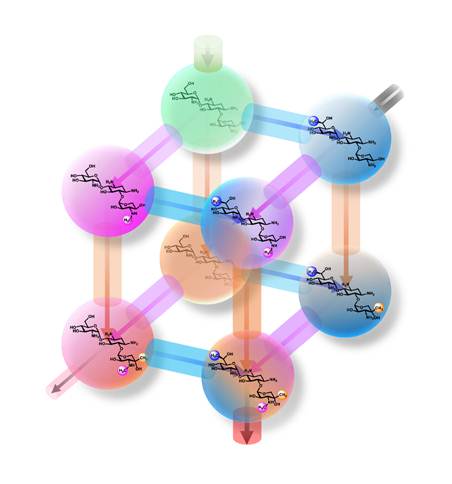
作为一个化学结构并不复杂的氨基糖苷分子,庆大霉素存在着令人惊奇的、极其复杂多样的甲基化和氨基化修饰,这些修饰既是庆大霉素结构多样性和生物活性展示的重要功能基团,同时也是耐药性产生的关键结构单元。孙宇辉教授课题组在成功解析了由庆大霉素A2到最终庆大霉素复合物的关键共同中间体的生物合成机制,以及破解了庆大霉素生物合成的关键中枢的基础上,与Peter F. Leadlay教授再度联手,系统地从分子遗传学、生物化学和化学生物学的角度揭示出全新的庆大霉素甲基化修饰的生物合成机制,其C- 6’、N-3’’和C-4’’上的甲基化相对独立,突破了人们对庆大霉素甲基化“串联式”顺序依次发生的传统认识,首次建立了“并联式”多轮甲基化修饰的立体网络模型(图1)。巧合的是这些经不同程度甲基化修饰的中间体恰好可以完美地位于正四面体的顶点,如果尚未甲基化的起始中间体从第一个顶点出发,经过任意一条通道,均可完成在C- 6’、N-3’’和C-4’’上的三步甲基化,最终到达与第一个顶点相对的出口。这不禁让人感叹自然界的创造力竟是如此的神奇和美妙!