近日,《德国应用化学》(Angewandte Chemie International Edition)在线发表了邓子新院士团队孙宇辉教授为通讯作者、博士生徐韡和翟贵发为共同第一作者的研究论文,报道了微生物聚酮合酶生物合成机制的又一项新的研究发现。
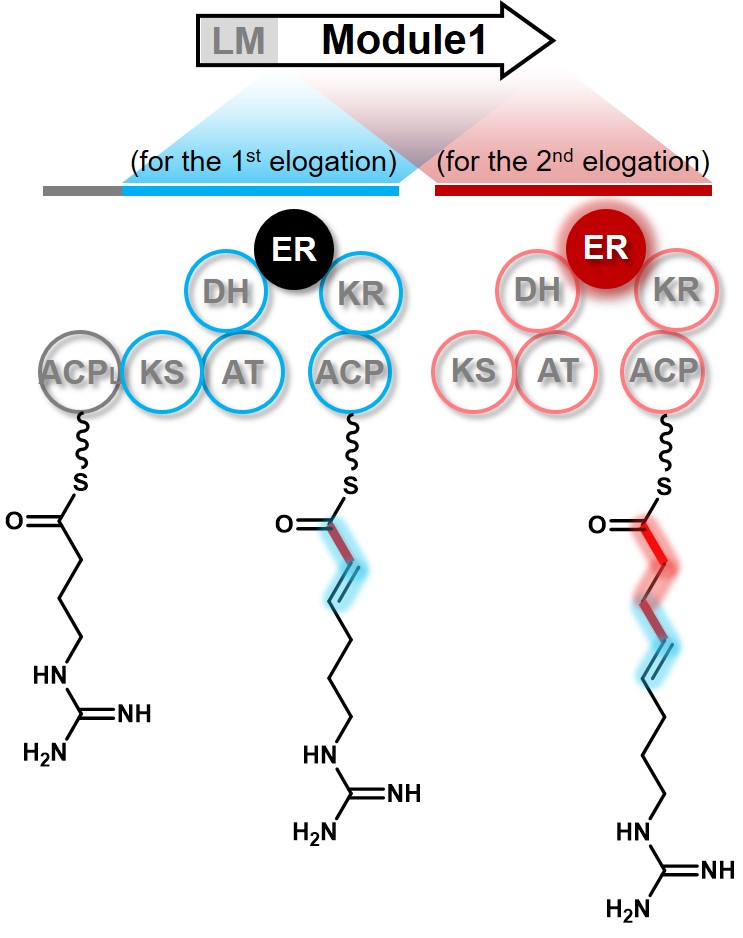
聚酮化合物是自然界功能、结构和活性最为多样化的天然产物之一,被称之为人类药物的天然宝库。它是由聚酮合酶(Polyketide synthase, PKS)催化形成的,其中还原结构域的种类和数量决定了聚酮化合物结构的多样性。尽管各种聚酮化合物结构各异,但它们基本都遵循着一套“结构与功能线性对应”的共同规律来实现分子结构的有序组装。这意味着人们可基于这一规律,预先通过聚酮合酶模块和结构域的理性设计,定向合成出全新的非天然“天然产物”,也正是聚酮合酶这一精巧的共线性特点,使之成为人们认识和改造天然产物的热点研究对象。然而,与这种结构与功能共线性规律相悖的“例外”则会进一步拓展并丰富人们对于这一基本规律的认识和应用。基于这种思维,孙宇辉教授研究组以来自于海南红树林的链霉菌Streptomyces sp. 211726所产生的36元大环内酯类聚酮化合物――阿扎霉素(Azalomycin F)为研究对象,通过系统的运用微生物分子遗传学及分子酶学研究手段,首次挖掘出暗藏在聚酮合酶中一种可自动开关的烯醇还原酶结构域及其催化机制,即在一个可重复使用的聚酮合酶模块中,同一个烯醇还原酶结构域可以根据需要在两次碳链延伸过程中,如电源开关般进行关闭或开启,从而催化形成不同的结构衍生物。这一新颖而独特机制的揭示不仅拓宽了人们对聚酮合酶经典的线性装配模式的认识,也将为新型聚酮化合物的创制提供新的理论指导。
邓子新院士团队成员长期扎实聚焦于微生物天然产物生物合成的机理性研究并及时拓展在药物结构和功能创新方面的应用,近年来不断取得一系列开拓性研究成果。孙宇辉教授领衔的这个新发现就是该团队在此领域的又一最新重要进展,无疑为聚酮药物的人工创新开拓了一项新的思维方向和创新途径。该研究得到国家自然科学基金面上项目资助。